Die neue Medizinprodukteverordnung: Medical Devices Regulation (MDR EU)
Am 26.05.2021 trat die Verordnung (EU) 2017/745 über Medizinprodukte (Medical Devices Regulation – MDR) in Kraft. Sie hat die Medizinprodukt-Richtlinie 93/42/EWG (Medical Devices Directive – MDD) sowie die Richtlinie über aktive implantierbare Medizinprodukte 90/385/EWG (Active implantable medical devices directive - AIMDD) abgelöst.
Mit der MDR steigen die Anforderungen, die Medizinproduktehersteller erfüllen müssen, um ihre Produkte in der EU verkaufen zu dürfen. Unter anderem wurden die Anforderungen der Konformitätsbewertungsverfahren erhöht, für die die Einbindung einer Benannten Stelle erforderlich ist. TÜV NORD ist wie bereits unter der alten Gesetzgebung eine der Europäischen Benannten Stellen (Benennungsumfang TÜV NORD CERT in NANDO).
Sichern Sie sich jetzt den Zugang zum europäischen Markt und kontaktieren Sie uns rechtzeitig für eine Zertifizierung nach der neuen MDR.
Aus MDD wird MDR
Die wichtigsten Änderungen für Hersteller von Medizinprodukten
Die neue Medizinprodukteverordnung (Medical Device Regulation) gilt nicht mehr nur für klassische Medizinprodukte, sondern auch für „Produkte ohne spezifischen medizinischen Verwendungszweck“ („Anhang XVI Produkte“).
Dazu gehören unter anderem Produkte zur „body modification“ oder „beautification“, also Produkte, die vom Anwender genutzt werden, ohne eine vom Hersteller bestimmte medizinische Wirkung zu haben, wie z.B. Produkte zur Fettabsaugung, Haarentfernung oder Hautglättung etc..
MDR-Quelle:
Artikel 1: Geltungsbereich
Um mit der technischen Entwicklung Schritt zu halten, wurden die Klassifizierungsregeln gegenüber der MDD überarbeitet. Für viele Hersteller bedeutet das, dass ihre Produkte in eine höhere Risikoklasse eingestuft werden.
MDR-Quelle:
Artikel 51: Klassifizierung
Hersteller müssen mindestens eine Person benennen, die für die Einhaltung der Rechtsvorschriften verantwortlich ist (Englisch: „Person responsible for regulatory compliance“ - PRRC). Der Artikel 15 der Medical Device Regulation (MDR) beschreibt das Anforderungsprofil und die Aufgaben der „Verantwortlichen Person“ (PRRC) im Detail.
MDR-Quelle:
Artikel 15: Qualifizierte Person
Die Verantwortung des Herstellers im Hinblick auf die Marktüberwachung wurde neu definiert. Die Medizinprodukteverordnung verlangt eine kontinuierliche und systematische Dokumentation, die auch die neuen Anforderungen an die klinische Nachbeobachtung (Post Market Clinical Follow-Up, PMCF) beinhaltet.
MDR-Quelle:
Artikel 83-100: Marktüberwachung
Im Hinblick auf die sichere Anwendung der Medizinprodukte verlangt die MDR eine klinische Bewertung der vorhandenen klinischen Studien und Publikationen. Im Rahmen des Konformitätsbewertungsverfahrens werden diese Unterlagen durch einen unserer klinischen Experten überprüft.
MDR-Quelle:
Artikel 61: Klinische Bewertung
Artikel 62-80: Klinische Prüfung
Die Medical Device Regulation sieht keinen Bestandsschutz vor. Das heißt, dass auch bereits genehmigte Medizinprodukte neu bewertet und zertifiziert werden müssen. Unter der MDD zugelassene Medizinprodukte dürfen maximal bis zum 26. Mai 2021 abhängig von der Laufzeit der EU-Bescheinigungen in den Verkehr gebracht werden.
Neben den „harmonisierten Normen“ gibt es nun sogenannte „Gemeinsame Spezifikationen (GS)“ für die Auslegung und Herstellung von Produkten. (MDR Art. 2,71)
Diese enthalten konkrete Angaben zu technischen Spezifikationen, notwendigen Prozessen und erforderlichen Nachweisen, die für bestimmte Produktkategorien einzuhalten sind, um die Übereinstimmung mit den grundlegenden Sicherheits- und Leistungsanforderungen zu belegen. Die Anwendung ist jedoch freiwillig, solange der „Stand der Technik“ nachweislich eingehalten wird.
MDR-Quelle:
Artikel 9: Gemeinsame Spezifikationen
Hersteller von Medizinprodukten der Klasse III und implantierbaren medizinischen Geräten müssen regelmäßig Berichte über deren klinische Leistungsfähigkeit („Summary of safety and clinical performance“, SSCP) erstellen und veröffentlichen. So sollen Laien, die diese Produkte nutzen, die Möglichkeit haben, sich über aktuelle Erkenntnisse zu informieren.
MDR-Quelle:
Artikel 55: Mechanismus zur Kontrolle der Konformitätsbewertungen
Artikel 61: Klinische Bewertung
Artikel 62-80: Klinische Prüfung
Um sicherzustellen, dass Medizinprodukte lückenlos identifizierbar und nachverfolgbar sind, führt die Medizinprodukteverordnung (MDR) ein System zur eindeutigen Produktidentifikation (Unique device identifier - UDI) ein.
Allen Medizinprodukten müssen einmalige UDI-Codes zugeordnet werden. Nach Ablauf einer von der Risikoklasse abhängigen Übergangsfrist müssen diese auch gut lesbar für Menschen und Maschinen auf dem Produkt bzw. der Verpackung angebracht werden.
Die Einführung des Systems zur eindeutigen Produktidentifikation ist für alle Produkte ab dem 26. Mai 2021 verpflichtend, die Anbringung der Kennzeichnung erst mit dem Ende der jeweils für die Risikoklasse festgelegten Übergangsfrist:
26. Mai 2021:
Implantierbare Produkte und Produkte der Klasse III
26. Mai 2023:
Klasse IIa und IIb Produkte
26. Mai 2025:
Klasse I Produkte
Falls die Produkte wiederverwendbar sind, muss zusätzlich die direkte Kennzeichnung des UID-DI auf dem Produkt (direct marking) etwa durch Lasergravur spätestens 2 Jahre nach der oben angegebenen Frist erfolgen.
MDR-Quelle:
Artikel 27
Der Ablauf einer MDR Zertifizierung

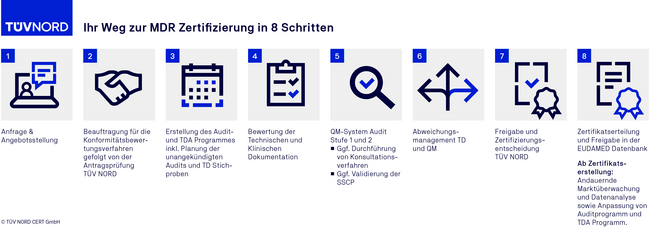
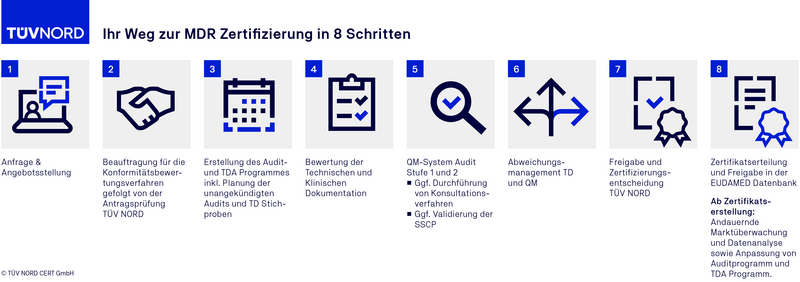
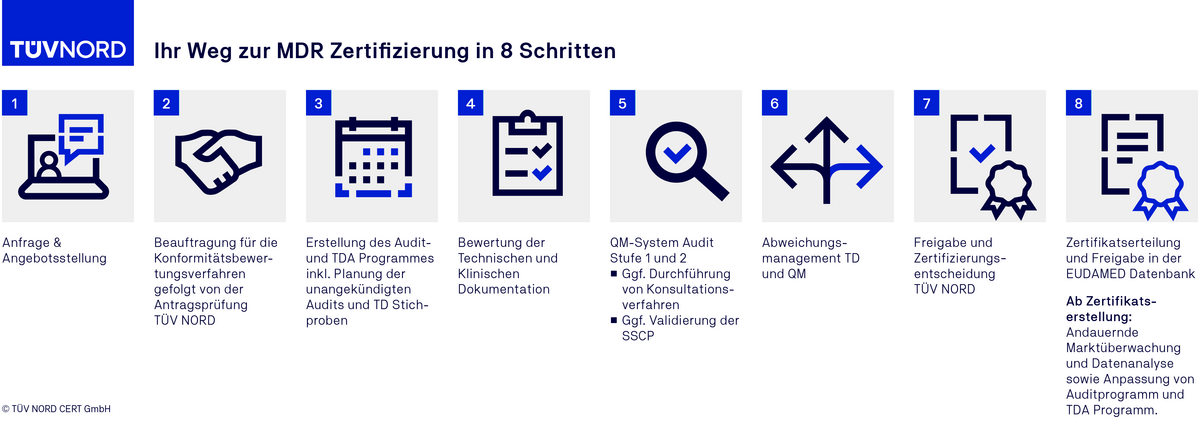
FAQ zum MDR Audit
Die Medizinprodukteverordnung oder Medical Device Regulation, die offiziell als (EU)2017/745 zitiert wird, ist eine harmonisierte Rechtsvorschrift. Hersteller, die die Verordnung erfüllen, dürfen ihre Produkte mit der CE-Kennzeichnung versehen und ungehindert in allen Europäischen Mitgliedsländern sowie den EFTA-Staaten vertreiben, ohne dass sie eine weitere Zertifizierung oder Zulassung benötigen.
Die Medizinprodukteverordnung löste zum 26.05.2021 die zuvor geltenden Europäischen Richtlinien ab. Damit ist sie die alleingültige Vorgabe für das Inverkehrbringen von Medizinprodukten in Europa.
Für einige wenige Produkte, für welche die Hersteller noch über gültige Konformitätsbescheinigungen verfügen (sogenannte „legacy devices“), gilt eine Ausnahme. Sie dürfen die Produkte noch bis zum 26.05.2024 in den Verkehr bringen. Voraussetzung ist, dass sie keinen „wesentlichen Änderungen“ unterzogen wurden.
European Commission / Nando (TÜV NORD CERT Notified Body) und Benennungsumfang
ZLG (Zentralstelle der Länder für Gesundheitsschutz bei Arzneimitteln und Medizinprodukten)
MDCG (Guidance - MDCG endorsed documents and other guidance)
EUDAMED (European Database on Medical Devices)
Die Medizinprodukteverordnung regelt die Anforderungen an die Sicherheit und Leistungsfähigkeit von Medizinprodukten sowie die Anforderungen an das Qualitätsmanagementsystem, unter dem diese Produkte entwickelt, hergestellt und in den Verkehr gebracht werden.
Nach fast 25 Jahren harmonisierter Anforderungen an Medizinprodukte haben sich die Technik und die Rechtsprechung so weit entwickelt, dass es erforderlich wurde, die bisherigen Europäischen Richtlinien für Medizinprodukte und aktive Implantate sowie die Gesetzgebung für In-Vitro-Diagnostika zu erneuern.
Ein direkter Auslöser für die Medizinprodukteverordnung (MDR) war außerdem der Brustimplantate-Skandal. Durch die neue Gesetzgebung sollen ähnliche Skandale in Zukunft verhindert werden.
Die neuen Verordnungen bringen den Vorteil mit, dass sie in den Mitgliedsländern nicht durch weitere Gesetze umgesetzt werden müssen. Sie können einheitlich interpretiert und von den Herstellern direkt angewendet werden.


