MDSAP: Ein Audit für fünf Märkte
In der Vergangenheit mussten Medizinproduktehersteller, die ihre Produkte in Australien, Brasilien, Kanada, Japan und den USA lizenzieren wollten, die Erfüllung der nationalen regulatorischen Anforderungen jedes Landes in unterschiedlichen Zulassungsverfahren zeit- und kostenintensiv nachweisen.
Das International Medical Devices Regulators Forum (IMDRF) hat daher ein einheitliches Programm entwickelt: Das Medical Device Single Audit Program (MDSAP) berücksichtigt die regulatorischen Anforderungen mehrerer Länder. Die Konformität der länderspezifischen Anforderungen kann seitdem von Herstellern im Rahmen eines einzigen Audits nachgewiesen werden.
TUV USA Inc. (Mitglied der TÜV NORD Gruppe) wurde als eine der ersten Prüforganisationen durch die Aufsichtsbehörden registriert und ist berechtigt MDSAP-Audits durchzuführen.




Vorteile einer Zertifizierung nach MDSAP
- Alle rechtlichen Anforderungen in Australien, Brasilien, Kanada, Japan und den USA werden von einem Audit erfüllt
- Beschleunigte Zulassung [3 Länder (Argentinien, Singapur und die Republik Korea) sind dem MDSAP-Programm als Assoziierte Mitglieder beigetreten]
- Betriebsunterbrechungen werden minimiert (nur noch ein Audit)
- Regulatorische Ressourcen können optimal genutzt werden
- Deutlich reduzierter Aufwand
- Reduzierte Auditzeit und -kosten
- Mehr Transparenz in der Branche
- Zusätzliche Synergien durch Inklusion weiterer Audits möglich (ISO 13485 / CE-Audit)
Der Auditablauf einer MDSAP Zertifizierung

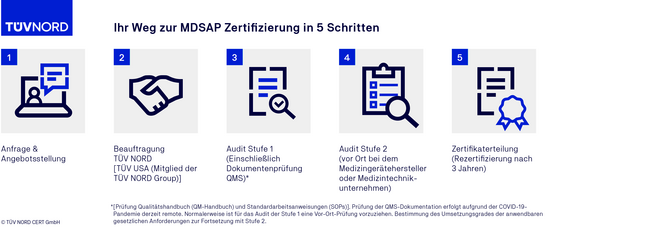
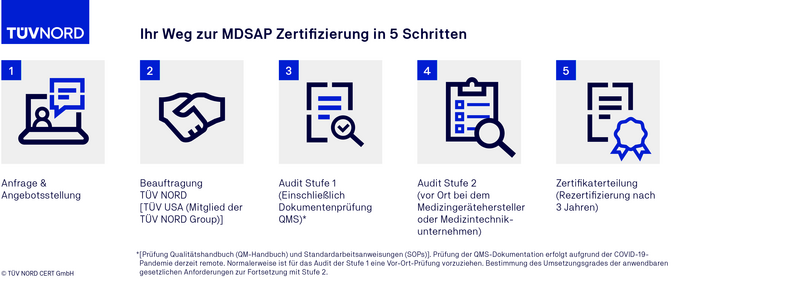
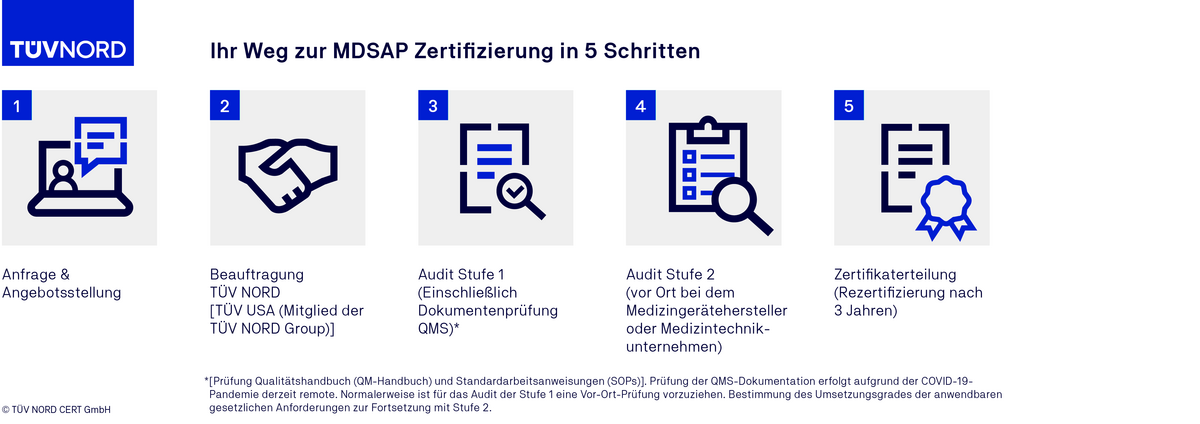
FAQ zum MDSAP Audit
MDSAP steht für „Medical Device Single Audit Program“ und bezeichnet ein Auditprogramm, bei dem die länderspezifischen Anforderungen der Mitgliedstaaten sowie die Anforderungen nach ISO 13485 in nur noch einem Audit geprüft werden.
Medizingerätehersteller / Medizintechnikunternehmen, deren Produkte (Medizingeräte) von mindestens einer am MDSAP-teilnehmenden Zulassungsbehörde zugelassen wurden, unterliegen mit ihrem Qualitätsmanagementsystem (QMS) den geltenden rechtlichen Anforderungen (Compliance).
Am 1. Januar 2019 hat auch Health Canada das Canadian Medical Devices Conformity Assessment System (CMDCAS) durch MDSAP ersetzt. Dieses bietet aktuell die einzige Möglichkeit für Medizingerätehersteller und Medizintechnikunternehmen, die Einhaltung der kanadischen Anforderungen an Qualitätsmanagementsysteme nachzuweisen. Um von Health Canada eine Zulassung für die Vermarktung ihrer Produkte zu bekommen, müssen Medizingerätehersteller und Medizintechnikunternehmen das MDSAP-Programm erfolgreich durchlaufen haben.
Das MDSAP folgt der Regel „überall oder nirgendwo“. Das bedeutet, wenn bei Eintritt in das Programm ein Produkt in allen teilnehmenden Ländern des MDSAP vermarktet werden soll, muss das Audit allen Anforderungen aller Mitgliedstaaten entsprechen. Eine Auswahl bestimmter Mitgliedstaaten für das Audit ist nicht möglich.
Soll ein Produkt hingegen nicht in allen teilnehmenden Ländern vermarktet werden, darf mit einem Mitgliedsland begonnen werden. Sobald weitere Märkte hinzukommen, kann der Audit-Umfang entsprechend erweitert werden.
Mitarbeiter in Rechts- und Außenhandelsabteilungen der Medizingerätebranche sowie im Bereich Qualitätsmanagement, aber auch interne und externe QM-Auditoren müssen das Auditkonzept des MDSAP befolgen und bestens mit den Anforderungen des Programms vertraut sein.
Im MDSAP-Auditkonzept sind alle Audit-Anforderungen des MDSAP dokumentiert. Das Dokument ist auf der Website der FDA erhältlich.
In den 7 Kapiteln des MDSAP werden verschiedene Aufgaben beschrieben:
Kapitel 1 Prozess: Management
Kapitel 2 Prozess: Marktzulassung von Medizingeräten und Registrierung von Einrichtungen
Kapitel 3 Prozess: Messung, Auswertung und Verbesserung
Kapitel 4 Prozess: Berichterstattung über unerwünschte Ereignisse mit Medizingeräten und Warnungen
Kapitel 5 Prozess: Konstruktion und Entwicklung
Kapitel 6 Prozess: Steuerung von Produktion und Wartung
Kapitel 7 Prozess: Einkauf
Neben den einzelnen Anforderungen enthält das MDSAP-Auditkonzept außerdem Erklärungen und Querverweise zwischen den einzelnen Aufgaben und den dazugehörigen gesetzlichen Anforderungen. Damit bietet es einen guten Überblick über die Erwartungshaltung während eines MDSAP-Audits.
Ein MDSAP-Audit kann grundsätzlich mit einer (bestehenden) CE-Zertifizierung oder Zertifizierung nach ISO 13485 kombiniert werden.
Das International Medical Devices Regulators Forum (IMDRF) wurde im Februar 2011 als Diskussionsforum gegründet. Künftig werden dort Ausrichtungen bei der Vereinheitlichung von gesetzlichen Vorgaben im Bereich der Medizintechnik diskutiert. Das Forum besteht aus freiwilligen Gruppierungen von Zulassungsbehörden der ganzen Welt und treibt die Vereinheitlichung von Vorgaben und Gesetzen in der internationalen Medizinbranche voran.